1.纳米酶多酶活性可逆切换的光调控分子开关
2024年3月21日,我院江苏省心脑血管药物重点实验室方一民教授课题组在Angewandte Chemie International Edition期刊在线发表题为《Photo-Switchable Peroxidase/Catalase-Like Activity of Carbon Quantum Dots》的研究论文。

纳米酶往往同时具有多种酶活性,可发挥不同酶活性之间的协同作用,调控生物体内的代谢平衡,对于维持机体的健康至关重要,因此其多酶活性的研究逐渐成为热点。然而,纳米酶多酶活性的精确操纵十分困难,往往缺乏可控的酶活性“开关”来实现多种酶活性的可逆切换,以适应不同生理阶段的酶活性需求。因此,开发具有多酶活性可切换的纳米酶调控生物体的代谢平衡,对实现精准治疗至关重要。基于此,课题组以聚苯胺为前体构建了一种新型的具有过氧化物酶(产生ROS)活性的氧氮功能化碳量子点(O/N-CQDs),并发现该O/N-CQDs的类过氧化物酶活性在光照射条件下可快速切换为过氧化氢酶(清除ROS)活性(如图1所示),进一步研究发现其光调控的分子开关源于纳米酶表面氮醌残基的光极化。且可通过光照强度的控制自由切换其ROS产生或清除活性。该研究通过非接触式的光刺激实现了纳米酶多种酶活性的自主调控,可利用其过氧化物酶活性高效杀灭病原体或癌细胞,再通过上调其过氧化氢酶活性促进伤口修复,可根据疾病的进展智能调控治疗策略,在精准医学中具有广阔的潜在应用价值。
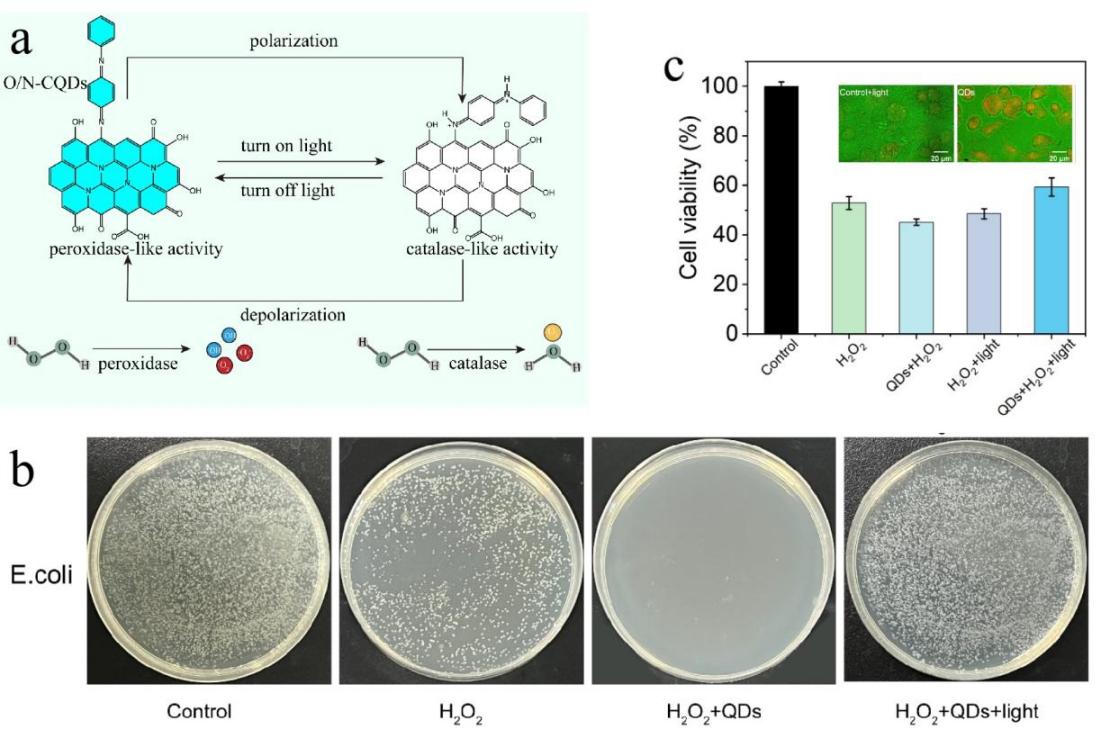
图1. (a)类过氧化物酶/过氧化氢酶活性可逆切换的纳米酶光调控分子开关示意图(b)细菌有效杀灭及(c)细胞活力恢复对照图。
该研究论文通讯作者为太阳成集团tyc7111cc心脑血管药物重点实验室方一民教授,第一作者为太阳成集团tyc7111cc2022级博士研究生杨威。本研究得到了国家自然科学基金等资助以及我院陈芸教授的大力支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202403581
2. 免标记单分子酶催化动力学监测技术实现单个非稳态酶暂态活性信息的快速、高通量获取
2024年2月11日,课题组在Small期刊在线发表题为《Absorption-Based Rapid Acquisition of Single-Molecule Kinetics from Unstable Enzymes in Microdroplets》的研究论文。

基于单分子酶催化活性的统计学分析可从微观角度反映酶分子的异质性,继而在单分子水平揭示酶分子的催化反应机理,为酶活性的理解提供新视野。然而,现有的单分子酶研究方法往往需要反应体系具有荧光性质,但受限于荧光的通用性的问题,难以实现无荧光反应体系的单分子酶反应动力学信息的快速获取。本研究利用反应体系的吸收光谱的变化,结合大视野暗场显微成像技术实现了免标记、高通量的单分子酶催化反应动力学的动态监测。得益于该方法所特有的快速、高通量的优势,本研究发现单分子酶催化反应速率常数分布呈指数衰减,而非传统的高斯分布,进一步研究表明该现象与酶活性的快速衰减密切相关,并从单分子水平澄清了酶的变性机制,为非稳态酶的暂态活性研究提供了新方法(图2)。
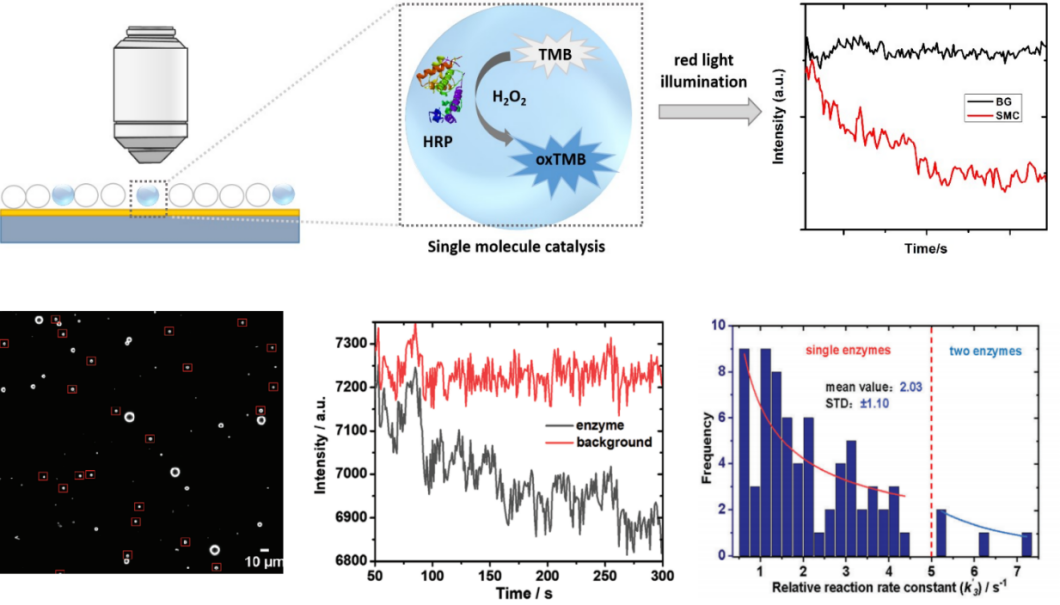
图2.大视野暗场显微成像技术实现无标记、高通量的单分子酶催化反应动力学监测。
该研究论文通讯作者为太阳成集团tyc7111cc心脑血管药物重点实验室方一民教授和徐州医科大学王鹏程博士(课题组22年毕业的博士生),第一作者为太阳成集团tyc7111cc2021级硕士研究生郑玉皓和陈劲虎同学。本研究得到了国家自然科学基金等资助。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/smll.202309463
(撰稿/方一民; 审核/陈宏山)


